联系我们
高脂喂养8周快速造模!ApoE-KO小鼠助力心血管药物研发突破
动脉粥样硬化(Atherosclerosis,AS)是一种慢性进行性血管病变,以动脉壁脂质沉积、炎症反应和斑块形成为主要特征。随着病程进展,动脉壁逐渐增厚、硬化导致管腔狭窄,引发多器官缺血性病变,临床表现为心绞痛、心肌梗死、脑卒中及下肢间歇性跛行等,常与高血压、糖尿病等代谢性疾病互相影响,形成恶性循环。AS因其发病隐匿和高危性,常被称为“血管系统的不定时炸弹”。
AS的发病机制复杂,涉及脂质代谢异常、炎症反应、内皮功能障碍等多因素相互作用,目前尚未完全阐明其具体调控网络。在基础研究中,尽管啮齿类动物(尤其是大小鼠)模型存在物种局限性,但其可控的遗传背景和可诱导的AS病理特征,仍使其成为探索AS发病机制及药物干预策略的首选模型体系。
动脉粥样硬化研究模型推荐——Apoe基因敲除小鼠
载脂蛋白E(Apolipoprotein E, ApoE)是脂质代谢的核心调控蛋白,其主要功能包括介导脂蛋白、胆固醇的转运及脂溶性维生素代谢。在外周组织中,ApoE主要由肝脏和巨噬细胞合成,通过调控低密度脂蛋白受体(LDLR)介导的脂蛋白摄取,维持胆固醇稳态;在中枢神经系统内,则由星形胶质细胞分泌,通过特异性受体介导胆固醇向神经元定向转运。研究表明,ApoE通过多种机制发挥抗动脉粥样硬化作用:促进乳糜微粒(CM)和极低密度脂蛋白(VLDL)的清除、调节巨噬细胞功能、参与胆固醇逆向转运、减轻炎症反应等。因此,Apoe是防治动脉粥样硬化性血管疾病的重要靶点。
斯莱克景达采用基因编辑技术在C57BL/6J背景上成功构建了Apoe基因敲除(ApoE⁻/⁻)小鼠。该小鼠品系ApoE蛋白功能受损,纯合突变小鼠在正常饮食下即表现出显著的高胆固醇血症,在高脂饮食诱导下可加快动脉粥样硬化进程,缩短模型构建周期,是研究动脉粥样硬化等心血管疾病的理想模型。
模型特征
■ 脂质代谢异常:ApoE−/−小鼠在普通饲料喂养下即出现严重的高胆固醇血症,其原因是Apoe敲除后造成了肝脏对脂蛋白的摄取能力下降,其中的CM和VLDL残粒蓄积在血中,而胆固醇主要富集于VLDL中,所以总胆固醇水平较正常小鼠升高数倍。
■ 动脉粥样硬化病变:ApoE−/−小鼠通常在6月龄以上会自发形成动脉粥样硬化,早期(3月龄)在主动脉根部出现脂质条纹,继续发展表现为主动脉弓、头臂干动脉及其分支出现纤维帽包裹的坏死核心,伴胶原沉积和钙化灶。高脂饮食可显著提升血浆总胆固醇水平,加速动脉粥样硬化发展,促进胆固醇结晶、坏死灶矿化及钙盐沉积的形成。
研究案例
药物(海藻糖释放纳米凝胶)抗动脉粥样硬化效果的体内评估:
在ApoE−/−小鼠高脂饮食(HFD)12周所诱导的动脉粥样硬化模型中,实验1组和2组每隔三天分别静脉注射一次海藻糖释放纳米凝胶(TNG)和游离海藻糖(Trehalose),持续4周。
以下是部分实验结果图,从A图可以看出对照组小鼠主动脉上脂质沉积范围广、程度重,出现大片融合性斑块;从C图可以看出对照组小鼠主动脉内膜增厚,大量脂滴聚集,血管腔因内膜增生而狭窄;从E、G图可以看出对照组小鼠主动脉免疫荧光图中荧光强烈,表明主动脉内膜组织的自噬功能受到损伤,已出现动脉粥样硬化病变。
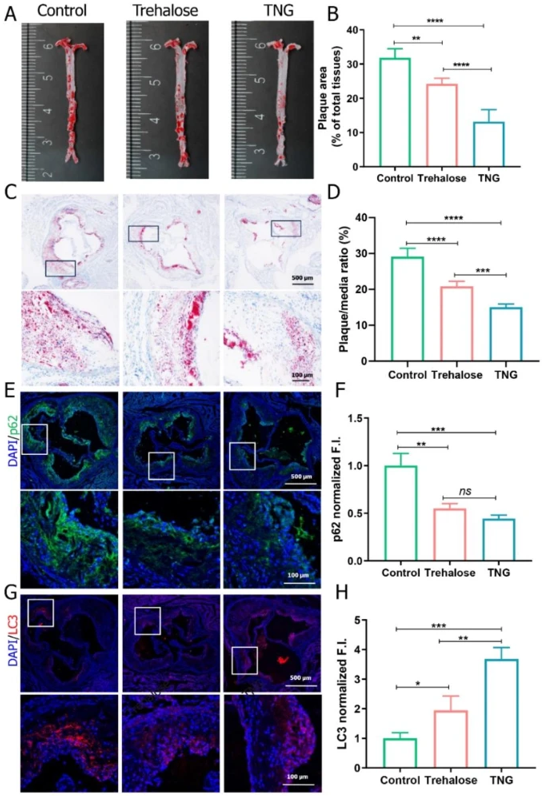
海藻糖释放纳米凝胶抗动脉粥样硬化效果评估[1]
ApoE−/−小鼠常见问题解析
ApoE−/−小鼠高脂饲料喂养多长时间,可诱导出动脉粥样硬化斑块?
在Apoe基因敲除小鼠动脉粥样硬化模型的构建过程中,饲料的配方设计(包括脂肪含量、胆固醇含量以及是否添加胆酸钠)对疾病的发生发展具有重要影响。
西方饮食D12079B(Research Diets)胆固醇含量为0.15%,造模周期约16周,适用于研究动脉粥样硬化长期演变过程。D12108C和D12109C胆固醇含量均为1.25%,但D12109C额外添加了胆酸钠,其主要通过胆汁酸循环增强胆固醇合成,显著提升血管壁炎症反应,加速动脉粥样硬化的发展。
D12108C造模周期约为12周,其高胆固醇负荷可在较短周期内形成中等程度的斑块,适合研究斑块动态形成机制及早期干预。D12109C造模周期约为8周,更易诱发炎症反应和肝毒性,可以更好地研究炎症微环境对动脉粥样硬化的影响。另外需注意,造模除了饲料,也会受到饲养条件等影响。
更多模型详细信息及相关问题咨询,
欢迎随时与我们取得联系,
我们将为您提供专业解答与支持。
参考文献:
[1] Zhong Y,Maruf A, Qu K, et al. Nanogels with covalently bound and releasable trehalose for autophagy stimulation in atherosclerosis.J Nanobiotechnology. 2023 Dec 8;21(1):472.
[2] Fang Y, Su H, Yin X, et al. Trehalose attenuates atherosclerosis via autophagy-dependent cholesterol efflux in ApoE-/- mice. J Transl Med 2022, 20(1): 219.
[3] Wang B, Bennett M. Aging and atherosclerosis: mechanisms, functional consequences, and potential therapeutics. Adv Drug Deliv Rev 2023, 196: 114-133.
[4] Hubbard B K, Calkin A C, Drew B G. Apolipoprotein E and atherosclerosis: from lipids to inflammation. J Clin Med 2021, 10(18): 4212.

实验动物订购电话: 0731-84877202/84877208
广东专线: 400-881-9598
技术服务热线: 0731-84876042
企业QQ: 800073177
邮箱: [email protected]
地址: 湖南省长沙市芙蓉区隆平产业开发区豪丹科技园3栋3楼

关注我们

